18 июля FDA (Управление по контролю качества пищевых продуктов и лекарственных средств США) одобрило Vosevi — новый комбинированный режим для терапии пациентов, потерпевших неудачу при терапии вирусного гепатита С ингибиторами NS5A или софосбувиром.
 Компания Gilead получила маркетинговое разрешение на новое комбинированное средство для лечения хронического вирусного гепатита С генотипов 1-6 среди взрослых пациентов без цирроза или легким циррозом. Препарат появится на рынке под торговым наименованием Восеви (Vosevi), сообщаетсяна сайте Администрации по контролю за продуктами и лекарствами США (FDA).
Компания Gilead получила маркетинговое разрешение на новое комбинированное средство для лечения хронического вирусного гепатита С генотипов 1-6 среди взрослых пациентов без цирроза или легким циррозом. Препарат появится на рынке под торговым наименованием Восеви (Vosevi), сообщаетсяна сайте Администрации по контролю за продуктами и лекарствами США (FDA).
В состав зарегистрированного ЛС вошли софосбувир, велпатасвир и новое соединение – воксилапревир. Воксилапревир является ингибитором протеазы 3/4A. В ведомстве рассказали, что Восеви стал первым препаратом, одобренным для лечения пациентов, ранее прошедших терапию софосбувиром или другими противогепатитными ЛС, ингибирующими NS5A.
Комбинированный препарат предполагает использование один раз в сутки, каждая таблетка содержит 400 мг софосбувира, 100 мг велпатасвира и 100 мг воксилапревира. Gilead установил цену на Vosevi в размере 24 920 долларов за упаковку 28 таблеток, уровняв ее с Epclusa, таблетка которого содержит 400 мг софосбувира, 100 мг велпатасвира (74 760 долларов за 12-недельный курс), т.е. фактически Gilead предоставляет третий компонент Vosevi бесплатно. Комбинация одобрена для повторной терапии вирусного гепатита С (ВГС) при предшествовавшей неудаче терапии всех генотипов режимами на базе ингибиторов NS5A, а также при неудачи терапии генотипа 1a или 3, где ранее применялся режим на базе сфосбуваира без ингибиторов NS5A.
В ключевых клинических исследованиях III фазы серии POLARIS оценивалась эффективность и безопасность 12 недель терапии Vosevi у пациентов без цирроза или с компенсированным циррозом печени, ранее получавших препараты прямого действия.
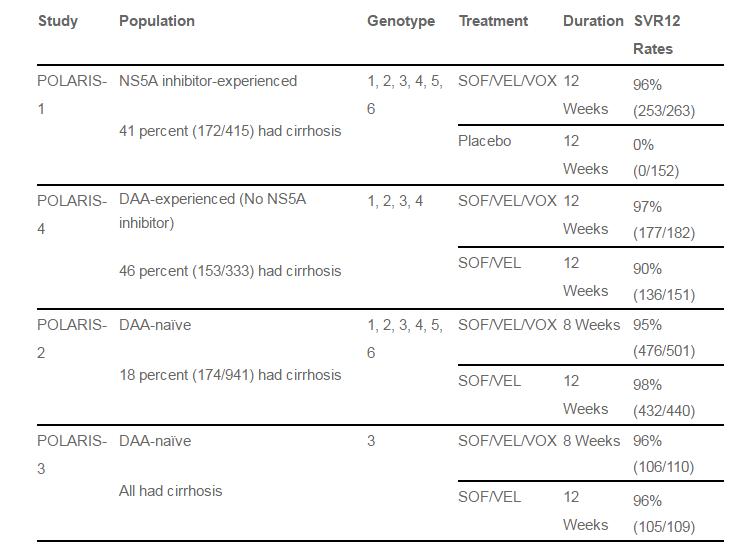
Исследование POLARIS-1 продемонстрировало эффективность 12-недельной терапии Vosevi у 96,2% (достижение устойчивого вирусологического ответа через 12 недель после окончания терапии, SVR12) у пациентов (n=263), ранее получавих режимы на базе ингибиторов NS5A. Каждый шестой пациент в данном исследовании имел значимые мутации лекарственной устойчивости.
В исследовании POLARIS-4 тройная комбинация Vosevi (n=181) сравнивалась с терапией софосбувиром и велпатасвиром (n=151) у пациентов с циррозом и без цирроза, ранее получавших режимы на базе софосбувира без использования ингибиторов NS5A или NS3, также исключались пациенты, получавшие классическую интерфероновую терапию с рибавирином. Тройной режим обеспечил SVR12 в 98% случаев, против 90% в случае двойного режима.
Переносимость Vosevi была на очень высоком уровне, и примерно соответствовала переносимости в группе плацебо. Наиболее часто наблюдались головная боль, повышенная утомляемость, диарея и тошнота.
Ранее FDA одобрила применение комбинации софосбувир + велпатасвир (ингибитор РНК-полимеразы NS5B). Эффективность и безопасность комбинированного ЛС была подтверждена результатами нескольких клинических исследований III фазы, в которых приняли участие пациенты с гепатитом С и с циррозом печени (или без него). Согласно полученным результатам, через 12 недель терапии новым ЛС у 95-99% вирус переставал определяться в крови.
Комитет EMA по лекарственным препаратам для человека (CHMP) для стран Евросоюза вынес позитивное решение по применению Vosevi еще 23 июня 2017 года.


